Batteri
Batteri er et galvanisk element. Det inneholder kjemisk lagret energi, som koblet i en krets vil omformes til elektrisk energi.
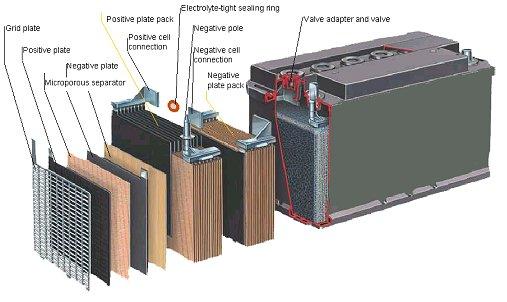
Dette er da hvordan et batteri er bygd opp. Stoffene batteriet inneholder kan varieres med tanke på holdbarhet, kapasitet og om det er primær eller sekundærbatteri (står om dette lengre nede).
De vanligste batteritypene er: A, AA, AAA, C, D og 9V.
Defenisjonen på et batteri er flere galvaniske celler som er samlet. Derfor er ikke A, AA, AAA, C og D egentlig batterier, men enkelte celler. Hvor stor volt man får per celle, kommer an på hva slags stoff som er inni cellene.
Innenfor batterier har vi 2 typer; primær og sekundærbatterier.
Forskjellen er at primærbatterier ikke kan lades opp igjen.
Når man lader et batteri, reverserer man redoksreaksjonen, og stoffene går tilbake til sin oprinnelige form.
Produktet av utladestrøm og det antall timer denne strøm kan tas ut, kalles for batteriets kapasitet, C.
Kapasiteten måles i ampere-timer, Ah. Ah er definert som en strøm på en ampere i en time, ampere er definert som 1 Colomb ladning pr sekund, tilnærmet lik 6,241*10 8elementærladninge (elektroner) pr sekund.
I forhold til blyakkumulatoren har NiCd-akkumulatoren likevel flere fordeler: den er mindre og lettere og den holder mer konstant spenning ved utladning og den beholder kapasiteten og belastningsegenskapene vesentlig bedre ved lave temperaturer.
Denne typen batteri er mest utbredt blant bilbatterier. Ved romtemperatur vil levetiden være 10–15 år når batteriet står som reservestrømskilde med regelmessig vedlikeholdslading. Brukes batteriet i syklusdrift,vil normalt klare 500–1500 opp og utladninger.
De 6 vanligste batteritypene. Dette er er alkaliske primær batterier, Fra venstre: D, C, AA, AAA, A og 9V.
Litium er det letteste av alle metaller og har et normalpotensial på 3,05 volt, som også er høyere enn for noe annet metall. Dette bidrar til at litiumbatteriene har høyere cellespenning og høyere energitetthet enn noe annet primærbatteri (2–2,5 ganger større energitetthet enn for det alkaliske batteriet). I tillegg har litiumbatteriene stabil utladespenning, gode lagringsegenskaper og gode belastningsegenskaper også ved lave temperaturer.
Det er også utviklet ladbare batterier (sekundærbatterier) av denne typen. Det har vært visse sikkerhetsmessige problemer tilknyttet batteriet. Pga. den høye energitettheten har det skjedd eksplosjonsaktige reaksjoner ved feilaktig bruk eller feil i utstyret som kortslutninger eller oppvarming.
Kilder:
http://snl.no/batteri/fysikk
Bilder:
http://media.snl.no/system/images/1897/batteri2.gif
http://upload.wikimedia.org/wikipedia/commons/e/e5/6_most_common_battery_types-1.jpg
http://jimsgarage.files.wordpress.com/2007/05/eurobat.jpg
Dette er da hvordan et batteri er bygd opp. Stoffene batteriet inneholder kan varieres med tanke på holdbarhet, kapasitet og om det er primær eller sekundærbatteri (står om dette lengre nede).
De vanligste batteritypene er: A, AA, AAA, C, D og 9V.
Defenisjonen på et batteri er flere galvaniske celler som er samlet. Derfor er ikke A, AA, AAA, C og D egentlig batterier, men enkelte celler. Hvor stor volt man får per celle, kommer an på hva slags stoff som er inni cellene.
Innenfor batterier har vi 2 typer; primær og sekundærbatterier.
Forskjellen er at primærbatterier ikke kan lades opp igjen.
Når man lader et batteri, reverserer man redoksreaksjonen, og stoffene går tilbake til sin oprinnelige form.
Et batteri har et begrenset energiinnhold som er bestemt av mengden av aktivt elektrodemateriale. Når dette er oppbrukt, vil strømmen slutte å gå.
Produktet av utladestrøm og det antall timer denne strøm kan tas ut, kalles for batteriets kapasitet, C.
C angis ofte som den kapasitet som kan lades ut i løpet av et antall timer, dette skrives som Cn der n er det antall timer som batteriet lades ut i løpet av. Eksempel C5 er den kapasitet batteriet har dersom det lades helt uti løpet av 5 timer, C20 er den kapasiteten en kan ta ut i løpet av 20 timer.
Kapasiteten måles i ampere-timer, Ah. Ah er definert som en strøm på en ampere i en time, ampere er definert som 1 Colomb ladning pr sekund, tilnærmet lik 6,241*10 8elementærladninge (elektroner) pr sekund.
Nikkel-metallhydridbatteriet
Nikkel-metallhydridbatteriet (NiMH), er kommet som et resultat av stor innsats for å komme bort fra de miljøfarlige tungmetallene bly, kvikksølv og kadmium. NiMH-batteriet er i hovedsak oppbygd som et NiCd-batteri, men den negative elektroden er erstattet av høyporøs hydrogenabsorberende legering av metallhydrider. Batteriet har mange av de samme, og til dels bedre, egenskaper som NiCd-batteriet. Men foreløpig har batteriet begrensinger som bl.a. kort lagringstid (høy selvutlading ved romtemperatur – mindre ved lave temperaturer) og små størrelser. I tillegg er batteriet kostbart.Nikkel-kadmiumakkumulatoren
Nikkel-kadmiumakkumulatoren, Nicad (NiCd), som ble patentert av svensken E. W. Jugner i 1899, har nikkelhydroksid som positivt elektrodemateriale og kadmium som negativt elektrodemateriale. Elektrolytten er kaliumhydroksid som ikke blir oppbrukt under den kjemiske prosessen, men som kun brukes som transportør av ioneladninger. Elektrolyttens densitet vil derfor forandres lite ved opp- og utladning. Det samme vil være tilfelle med cellespenning og indre motstand. Batteriets ladetilstand blir derfor ikke så enkel å måle, og oppladningen blir heller ikke så enkel som for blybatteriet.I forhold til blyakkumulatoren har NiCd-akkumulatoren likevel flere fordeler: den er mindre og lettere og den holder mer konstant spenning ved utladning og den beholder kapasiteten og belastningsegenskapene vesentlig bedre ved lave temperaturer.
Blyakkumulatoren
Blyakkumulatoren er det eldste og fremdeles mest brukte sekundærbatteri. Den ble oppfunnet av den franske fysiker G. Planté allerede i 1859 og senere forbedret av hans elev C. Faure. I ladet tilstand består den positive elektroden av blydioksid (PbO2) og den negative består av porøst bly (blysvamp). Elektrolytten er svovelsyre. Ved utlading reduseres blydioksid på positiv pol ved at oksygenioner går ut i elektrolytten og forbinder seg med hydrogenioner til vann. Sulfationer i svovelsyren går til begge elektroder og danner blysulfat. Elektrolytten deltar således i prosessen og går over til vann ved utlading. Prosessen kan skrives: Pb + 2H2SO4 + PbO2 → PbSO4 + 2H2O + PbSO4Denne typen batteri er mest utbredt blant bilbatterier. Ved romtemperatur vil levetiden være 10–15 år når batteriet står som reservestrømskilde med regelmessig vedlikeholdslading. Brukes batteriet i syklusdrift,vil normalt klare 500–1500 opp og utladninger.

Alkalisk sink-manganoksidbatteriet
Alkalisk sink-manganoksidbatteriet er oppbygd som et brunsteinbatteri, og har en elektrolytt av kaliumhydroksid (KOH). Dette batteriet har lavere indre motstand og tåler dermed atskillig større strømbelastning enn det vanlige brunsteinbatteriet. I tillegg har batteriet atskillig større kapasitet og energitetthet (3–4 ganger større enn for brunsteinbatteriet), og det kan også brukes ved lavere temperatur. Batteriet er imidlertid mer kostbart.Litiumbatterier
Litiumbatterier er en gruppe primærbatterier som har fått stigende utbredelse de senere år. De kjennetegnes ved at de alle har litium som anodemateriale. Katodematerialet er forskjellig med svoveldioksid som det mest utbredte.Litium er det letteste av alle metaller og har et normalpotensial på 3,05 volt, som også er høyere enn for noe annet metall. Dette bidrar til at litiumbatteriene har høyere cellespenning og høyere energitetthet enn noe annet primærbatteri (2–2,5 ganger større energitetthet enn for det alkaliske batteriet). I tillegg har litiumbatteriene stabil utladespenning, gode lagringsegenskaper og gode belastningsegenskaper også ved lave temperaturer.
Det er også utviklet ladbare batterier (sekundærbatterier) av denne typen. Det har vært visse sikkerhetsmessige problemer tilknyttet batteriet. Pga. den høye energitettheten har det skjedd eksplosjonsaktige reaksjoner ved feilaktig bruk eller feil i utstyret som kortslutninger eller oppvarming.
Kilder:
http://snl.no/batteri/fysikk
Bilder:
http://media.snl.no/system/images/1897/batteri2.gif
http://upload.wikimedia.org/wikipedia/commons/e/e5/6_most_common_battery_types-1.jpg
http://jimsgarage.files.wordpress.com/2007/05/eurobat.jpg


Ingen kommentarer:
Legg inn en kommentar